デジタルヘルスの今と可能性
第46回
日本におけるAI医療機器の
申請と承認状況の現状
「デジタルヘルス」の動向を考えずに今後の地域医療は見通せない。本企画ではデジタルヘルスの今と今後の可能性を考える。今回は、AI医療機器の最新動向について迫っていく。
日本における医療機器の定義
今回は、AI医療機器について話をしていこうと思う。というのも、私が共同創業したAI医療機器メーカーであるアイリス株式会社が、6月16日に日本初の事例として、治験をしてAI医療機器の承認申請を行ったためだ。
おそらく、AI医療機器は、これからさらに医療現場で使用されるにようになるはずである。そのため、AI医療機器ならびにデジタルを活用した医療機器である、「プログラム医療機器(SaMD:Software as a Medical Device)」について掘り下げていく。
そもそも、SaMDについての話をする前に、「医療機器」の定義はご存じだろうか。
日本における「医療機器」の定義は、医薬品医療機器等法(薬機法)の第2条で、次のように示されている。
「人もしくは動物の疾病の診断、治療もしくは予防に使用されること、または人もしくは動物の身体の構造もしくは機能に影響をおよぼすことが目的とされている機械器具等(再生医療等製品を除く)であって、政令で定めるもの」
簡単に言うと、「疾病の診断、治療、予防や身体の構造、機能に影響を与える」ことを使用目的としているものを指している。
たとえば、コンビニなどで普通に購入できるハサミは、文具であり医療機器ではない。これは、「紙を切る」ことなどを使用目的としているからだ。しかし、このハサミの切れ味が良いため、このハサを開発している企業が「手術で使ってもらいたい」と思って、まったく同じものを売り始めた場合、これは「疾患の治療」に該当するために、医療機器となる。
「使用目的」とは、こういうことである。仮に同じ構造・仕組みのものでも、どういう目的で使いたいと開発企業が意図しているどうかで、医療機器か、そうでないかが変わってくる。
医療機器はリスクに応じて、リスクが低い順から、▽クラスI(一般医療機器)、▽クラスII(管理医療機器)、▽クラスIII・クラスIV(高度管理医療機器)――に分類されている。クラスIにはメスやピンセット、X線フィルムのようなものが分類されており、クラスIVにはペースメーカーや人工心臓弁、ステントグラフトなどがある。
このリスク分類とは何かといえば、一番影響してくるのは、医療機器の審査である。クラスに分類される医療機器は、基本的に製造販売の届出をするだけでいいのだが、クラスII以上の医療機器に関しては、認証もしくは承認といった手続きが必要となる。
AI医療機器の申請方法と承認状況
では、SaMDとは何かというと、2014年11月の薬機法改正にともなって明示された、「ソフトウェアで疾患の治療・診断・予防に使うもの」のことである。つまり、アプリなどのソフトウェアであっても、しかるべき手続きを踏めば、医療機器として認証されるようになったのだ。
この代表例が、昨年6月に医療機器の承認を受けた、株式会社CureAppの禁煙治療用アプリだ。このアプリについては昨年12月から保険適用もされ、実際に禁煙治療の患者へ治療用アプリを処方する世界観を実現している。
このような「ソフトウェアで疾患の治療・診断・予防に使うもの」のなかでも、ソフトウェアがAIのものを、一般的にAI医療機器と呼んでいる。これらのAI医療機器は、承認申請のために、「原則として、治験として実際の医療現場で使って性能の評価を行う必要がある」とされている。
前置きが長くなったが、「疾患の診断のためにAIを開発し、日本で初めて前向きに治験を実施して性能の評価を行い、医療機器の承認申請を出した」のが、当社のAI医療機器である。
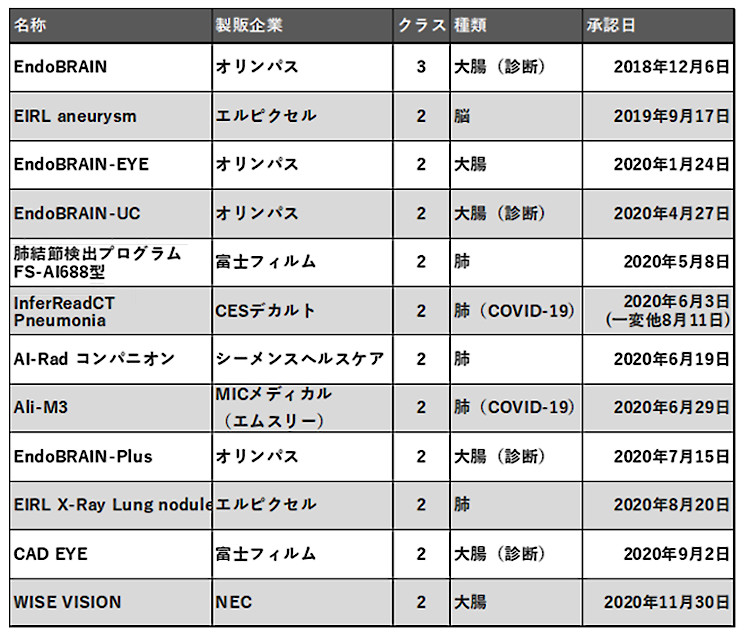
ただ、日本で初めて治験を実施したAI医療機器の承認申請を行った、と書いたが、一方で日本ではすでに12のAI医療機器が承認されており、医療現場で使える状況にある(表)。
これはなぜかといえば、先ほど書いたようにAI医療機器の承認申請は、「原則として」数億の費用と時間をかけた治験が必要とされているが、必ずしも治験を行わなくてもAI医療機器がつくれるということだ。
具体的に説明すると、すでに医療機関にあるデータや診療情報を利用してAI医療機器の性能評価を行うのならば、治験をする必要はない。AI医療機器開発を行っているメーカーの資料を見ると、「AIの開発が完了していて、画像や診療情報さえあれば、“半年~1年”、そして“数百万円”でAI医療機器の申請が可能」と書かれている。実は、このような事実はあまり知られていない。
厚生労働省はSaMDの審査の抜本改革を行っており、それを「DASH for SaMD」と呼称し、最先端のブログラム医療機器の早期実用化を促進しようとしている。そのために、審査の考え方の公開や相談窓口の一元化など、特にSaMDの推進に向けた体制が整備されてきている。
21年4月には、厚労省の医療機器審査管理課に「プログラム医療機器審査管理室」が設置された。また、医薬品医療機器総合機構(PMDA)にも「プログラム医療機器審査室(SaMD室)」が設置されたほか、薬事・食品衛生審議会の医療機器・体外診断用医薬品部会の下にも、「プログラム医療機器調査会」が置かれた。
こうした制度側の整備が進むなか、ますます医療機関で使えるAI医療機器が増えていくはずであり、とても楽しみだ。(『CLINIC ばんぶう』2021年8月号)
表 国内のAI医療機器承認状況(現在12)
(京都府立医科大学眼科学教室/東京医科歯科大臨床准教授/デジタルハリウッド大学大学院客員教授/千葉大学客員准教授)
かとう・ひろあき●2007年浜松医科大学卒業。眼科専門医として眼科診療に従事し、16年、厚生労働省入省。退官後は、デジタルハリウッド大学大学院客員教授を務めつつ、AI医療機器開発のアイリス株式会社取締役副社長CSOや企業の顧問、厚労省医療ベンチャー支援アドバイザー、千葉大学客員准教授、東京医科歯科大臨床准教授などを務める。著書は『医療4.0』(日経BP社)など40冊以上

